2011年高考化学试卷(新课标)(解析卷)
2011年全国统一高考化学试卷(新课标)参考答案与试题解析 一、选择题1 .下列叙述正确的是()A.1.00molNaCl中含有6.02×1023个NaCl分子B.1.00molNaCl中,所有Na+的最外层电子总数为8×6.02×1023C.欲配置1.00L,1.00mol.L1﹣的NaCl溶液,可将58.5gNaCl溶于1.00L水中D.电解58.5g熔融的NaCl,能产生22.4L氯气(标准状况)、23.0g金属钠【考点】54:物质的量的相关计算;5C:物质的量浓度的相关计算.菁优网版权所有【分析】根据物质的构成、离子的电子排布来分析微粒的物质的量,并根据溶液的配制来分析溶液的体积,利...
相关推荐
-
曲一线系列初中《5中考3年模拟》2023专题解释全国道德与法治资料包05专题五 走进社会生活 遵守社会规则VIP免费

 2024-11-21 24
2024-11-21 24 -
曲一线系列初中《5中考3年模拟》2023专题解释全国道德与法治资料包05专题五 走进社会生活 遵守社会规则VIP免费

 2024-11-21 21
2024-11-21 21 -
曲一线系列初中《5中考3年模拟》2023专题解释全国道德与法治资料包03专题三 青春时光 做情绪情感的主人VIP免费

 2024-11-21 15
2024-11-21 15 -
曲一线系列初中《5中考3年模拟》2023专题解释全国道德与法治资料包03专题三 青春时光 做情绪情感的主人VIP免费

 2024-11-21 19
2024-11-21 19 -
曲一线系列初中《5中考3年模拟》2023专题解释全国道德与法治资料包02专题二 友谊的天空 师长情谊VIP免费

 2024-11-21 19
2024-11-21 19 -
曲一线系列初中《5中考3年模拟》2023专题解释全国道德与法治资料包02专题二 友谊的天空 师长情谊VIP免费

 2024-11-21 20
2024-11-21 20 -
曲一线系列初中《5中考3年模拟》2023专题解释全国道德与法治资料包01专题一 成长的节拍 生命的思考VIP免费

 2024-11-21 21
2024-11-21 21 -
曲一线系列初中《5中考3年模拟》2023专题解释全国道德与法治资料包01专题一 成长的节拍 生命的思考VIP免费

 2024-11-21 21
2024-11-21 21 -
曲一线系列初中《5中考3年模拟》2023专题解释全国道德与法治资料包《53中考》全国道德与法治资料包VIP免费

 2024-11-21 24
2024-11-21 24 -
曲一线系列初中《5中考3年模拟》2023专题解释全国道德与法治资料包07专题七 坚持宪法至上 崇尚法治精神VIP免费

 2024-11-21 18
2024-11-21 18
相关内容
-

2025届重庆市西南大学附属中学高三下学期5月全镇模拟物理试题(含答案)
分类:中学教育
时间:2025-12-31
标签:无
格式:PDF
价格:10 玖币
-

2025届重庆市西南大学附属中学高三下学期5月全镇模拟化学试题(含答案)
分类:中学教育
时间:2025-12-31
标签:无
格式:PDF
价格:10 玖币
-
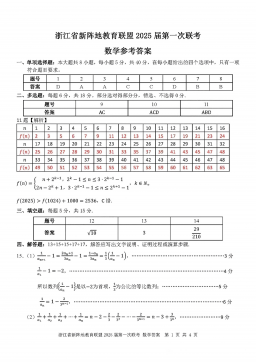
2025届浙江省新阵地联盟高三10月联考数学答案
分类:中学教育
时间:2025-12-31
标签:无
格式:PDF
价格:10 玖币
-

2025届重庆市西南大学附属中学高三下学期5月全镇模拟数学试题(含答案)
分类:中学教育
时间:2025-12-31
标签:无
格式:PDF
价格:10 玖币
-

2025届重庆康德三诊英语+答案
分类:中学教育
时间:2026-01-03
标签:无
格式:PDF
价格:10 玖币




 渝公网安备50010702506394
渝公网安备50010702506394
